REPORTE DE CASO

MVZ.ESP. Pedro Emanuel Hernández López
Introducción
Obstrucción aérea recurrente (RAO), conocida como “heaves”, es una patología debilitante e incurable, de las vías respiratorias bajas en el equino, manifestando broncoconstricción e inflamación neutrofílica respiratoria, como resultado de la exposición de irritantes aéreos específicos, y alérgenos encontrados en pasturas y camas polvosas.
Es una condición asmática que se manifiesta en caballos adultos maduros (más de 5 años), expuestos a polvos.
Esta patología es caracterizada por neutrofilia y una excesiva producción de moco, resultando en una reducción de la complianza dinámica pulmonar.

Figure 1: Ingreso del paciente de interés el medio de transporte (demasiado viento).
DESARROLLO DE CASO:
Diagnóstico clínico orientado a problemas.
Historia clínica orientada a problemas:
Base de datos del paciente:
Macho castrado, de 7 años de edad.
Raza Gipsy Vanner.
Peso 376 kg.
Dedicado a show circense.
Viajes constantes, (cambios climáticos radicales).
Espacio vital en grupo, misma especie. Cama aserrín.
Desparasitación actualizada.
Vacunación incierta.
Interrogatorio de historia:
Patología respiratoria crónica, previamente tratada hace 60 días, aparentemente resuelta, antibioticoterapia desconocida, AINES, guayacol, vitamina B12, y otras más, Tos frecuente cuando ingiere alimento, pérdida progresiva de peso, séptima opinión médica. Ración a base de alfalfa.
Examen físico:
Relevante; pérdida de peso, línea de huélfago, taquipnea, taquicardia.
Lista problema:
- 1) Frecuencia respiratoria aumentada (28 RPM)
- 2) Sibilancias
- 3) Tos. (polvo).
- 4) Frecuencia cardiaca aumentada (62 LPM)
- 5) Respiración abdominal
- 6) Dilatación marcada de ollares. (Fig. 2)
- 7) Línea de huélfago
- 8) Pérdida de peso progresiva

Figura 2: Observe la dilatación de ollares.
Clasificación de problemas:
Importantes crónicos.
Lista maestra:
- Disnea; (1,4,5,6,7,8)
- Reflejo tusígeno positivo (3)
- Taquicardia (1,3,4,5,6,8,9)
Diagnósticos diferenciales:
Obstrucción aérea recurrente.
Obstrucción pulmonar asociado a pasturas.
Patología intersticial pulmonar crónica.
Fibrosis pulmonar.
Enfermedad inflamatoria respiratoria.
Plan diagnóstico:
I. Aspirado trans-traqueal (Fig.3),(citología).
II. Hemograma. (Fig. 3a)
III. Perfil bioquímico. (Fig. 3b)
IV. Gases sanguíneos. (Fig. 3c)
V. Estudio radiológico.(Fig 5)
VI. Ultrasonido
VII. Endoscopia. (Fig. 6)
VIII. Prueba broncodilatación (atropina). (Fig. 7)
Resultados:
I.- Aspirado trans-traqueal:
Muestra con abundante cantidad de células inflamatorias, en donde el mayor porcentaje son Neutrofilos (99%) en diferentes estados de conservación y algunos en cariorrexis, el 1 % restante son macrófagos, (Fig. 4) estas células se encuentran sobre un fondo de material mucoide rosáceo. Extracelularmente se observan escasas cadenas de bacterias.
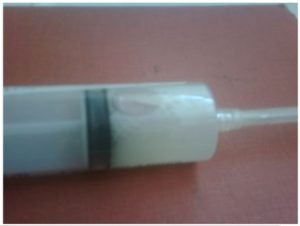
Figura 3: Sitio de punción para aspirado trans-traqueal. Figura 4: Observe la turbidez del aspirado por celularidad.
II.- Hemograma. (Figura 3a)
| ANALITO | UNIDADES | RESULTADO | VALORES DE REFERENCIA | OBSERVACIONES |
| hematocrito | L/L | 0.43 | 0.32-0.52 | |
| hemoglobina | g/L | 135 | 111-190 | |
| eritrocitos | X 10 a la 12/L | 8.8 | 6.5-12.5 | |
| VGM | lL | 49 | 34-58 | |
| CGMH | g/L | 314 | 310-370 | |
| proteínas | g/L | 78 | 60-80 | |
| fibrinógeno | g/L | 4 | <5 | |
| leucocitos | X10 a la 9/L | 9.2 | 5.5-12.5 | |
| plaquetas | X10 a la 9/L | 310 | 100-600 | |
| DIFERENCIAL | ||||
| NEUTROFILOS | X10 a la 9/L | 6.4 | 2.7-6.7 | |
| BANDAS | X10 a la 9/L | 0.1 | 0 | Elevado |
| METAMIELOCITOS | X10 a la 9/L | 0 | 0 | |
| MIELOCITOS | X10 a la 9/L | 0 | 0 | |
| LINFICITOS | X10 a la 9/L | 1.7 | 1.5-7.5 | |
| MONOCITOS | X10 a la 9/L | 0.3 | 0-0.8 | |
| EOSINOFILOS | X10 a la 9/L | 0.7 | 0-0.9 | |
| BASOFILOS
E. NUCLEADOS |
X10 a la 9/L
/100 leucos. |
0
0 |
0-0.2
0 |
|
| NEUTRO. TOXICOS | neg. | Negativo | ||
| LINFO. ATIPICOS | neg. | Negativo | ||
| MORFOLOGIA DE ERITROCITOS | NORMAL | |||
| INTERPRETACIÓN | ||||
| DESVIACIÓN A LA IZQUIERDA POR INFLAMACIÓN CRÓNICA | ||||
III.- Perfil Bioquímico. (Figura 3b)
| UNIDADES | RESULTADO | VALORES DE REFERENCIA | OBSERVACIONES | |
| GLUCOSA | mmol/L | 5.32 | 3.4-6.2 | |
| UREA | mmol/L | 7.3 | 4.1-7.2 | ELEVADO |
| CREATININA | Mmol/L | 107 | <156 | |
| COLESTEROL | mmol/L | 1.81-4.65 | ||
| BILIRRUBINA T. | Mmol/L | 34.2 | <54 | |
| BIL. CONJUGADA | Mmol/L | 3.5 | <12 | |
| BIL. NO CONJ. | Mmol/L | 30.7 | <44 | |
| ALT | U/L | |||
| AST | U/L | 495 | <450 | ELEVADO |
| FOSFATASA A. | U/L | <453 | ||
| GGT | U/L | 24 | <22 | ELEVADO |
| CK | U/L | 146 | <425 | |
| PROTEINAS T. | g/L | 72 | 53-71 | ELEVADO |
| ALBUMINA | g/L | 35 | 31-39 | |
| GLOBULINAS | g/L | 37 | 20-35 | ELEVADO |
| RELACION A/G | calculado | 0.9 | 0.89.1’65 | |
| CALCIO | mmol/L | 2.84 | 2.79-3.22 | |
| FOSFORO I. | mmol/L | 0.96 | 0.77-1.67 | |
| POTASIO | mmol/L | 3.67 | 3.36-4.99 | |
| SODIO | mmol/L | 132 | 132-141 | |
| CLORO | mmol/L | 95.9 | 98-105 | DISMINUIDO |
| BICARBONATO | mmol/L | 30 | 27-34 | |
| AC. NO VOLATILES | mmol/L | 9.8 | 4.0-13 | |
| cr/Urea: | 14.7 | INTERPRETACIÓN | ||
| Bc/Bnc: | 0.1 | |||
| Ca/P: | 3 | Hiperglobulinemia, por inflamación crónica. | ||
| Diferencia iones | 36.1 | Cambios restantes poco significativos. | ||
| Fuertes | ||||
Aspartato aminotranferasa (AST) Y gamma glutamil transpeptidasa (GGT), elevadas por balance energético negativo y movilidad lipídica. (Lipidosis hepática). Pérdida de peso. Hiperproteinemia por hiperglobulinemia, ligada a un proceso de estimulación inmune, (inflamación crónica).
IV.- Gasometría
Hipoxemia, (alcalosis respiratoria), por hiperventilación compensatoria, debido al daño pulmonar, hiperbicarbonatemia e hipocloremia perdida a terceros espacios, (Fig. 3c).
Figura 3c.
| ANALITO | UNIDADES | RESULTADO | VALORES DE REFERENCIA |
| pH | 7.449 | 7.350 – 7.460 | |
| pCO2 | mmHg | 40.1 | 36.0 – 44.0 |
| pO2 | mmHg | 44.4 | 81.0 – 103 |
| Valores de metabolitos | |||
| Glucosa | mmol/L | 5.7 | 3.8 – 6.8 |
| Lactato | mmol/L | 1 | 0.0 – 2.0 |
| Bilirrubina | mg/dl | 3.2 | – |
| Valores de electrolitos | |||
| K | mmol/L | 3.7 | 3.5 – 5.5 |
| Na | mmol/L | 131 | 140 – 153 |
| Ca? | mmol/L | 1.52 | 1.20 – 1.50 |
| Cl | mmol/L | 98 | 107 – 117 |
| HCO3 | mmol/L | 25 | 18-24 |
Diferencia de iones fuertes normal 33mmol /l.
V.- Estudio Radiológico
Toma latero lateral torácica: (Figura 5).
Patrón bronco vascular e intersticial.

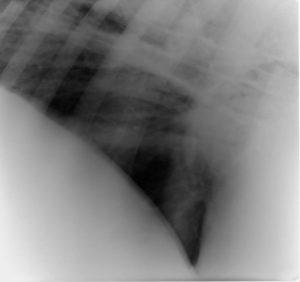
Figura 5: Toma radiográfica, latero-lateral torácica, observe el patrón bronquial e intersticial pulmonar.
VI.- Ultrasonido
Pequeñas áreas hiperecoica irregulares en la pared pulmonar.
VII.- Endoscopia
Exceso de material mucoso en lumen traqueal y Carina. (Fig. 6) .
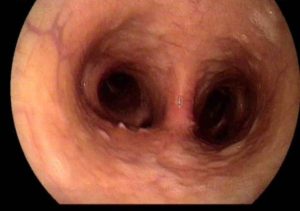
Figura 6: Apreciación de carina con abundante exudado mucoso.
VIII.- Test broncodilatación con atropina
Prueba positiva: (Fig. 7)
Se aplicó atropina subcutánea 0.02 mg/kg pv. Se observó un aumento de pO2 a 25 minutos post-administración: logrando incremento de 5.4 mmHg de pO2, y una disminución de pCO2 de 9.5 mmHg.
Descripción de análisis de gases y electrolitos: se observa hipoxemia, alcalosis respiratoria por hipocapnia, (hiponatremia inespecífica), hipocloremia por pérdida a terceros espacios, alcalosis metabólica hipoclórica, e hiperbicarbonatemica.
Diagnostico presuntivo y definitivo:
Por historia y Signología clínica, confirmada con pruebas de laboratorio e imagenologicas.
Obstrucción Aérea Recurrente. (RAO).
Plan de tratamiento inicial:
1) TPR q 4 horas.
2) Ipratropio 360 mg/salbutamol 63 -210 mg/kg. BID, inhalado.
3) Fluticasona 2000 mg BID, inhalado.
4) Hematocrito/proteína plasmática SID.
5) Ceftiofur, (de depósito) 6,6 mg/kg pv q 5 días. IM.
6) Dexametasona 2% .4mg/kg pv SID primeros tres días.
7) Isonicotinato de dexametasona (de depósito) 0.04 mg/kg pv q 5 días. IM posterior a los 3 días de administración de dexametasona convencional.
Manejo de microambiente:
8) Dieta, heno de avena húmeda, BID, agua ad-libitum.
9) Sacar a caminar, una vez al día.
10) Aromaterapia.
11) Aseo de caballeriza dos veces al día, mantener sin cama.
Plan de seguimiento:
Se intentó obtener datos de constantes, durante el periodo de hospitalización, logrando graficar a groso modo, la frecuencia respiratoria y el ritmo cardiaco en el periodo de hospitalización, observando una mejoría en estos factores hasta el día de obtenida el alta. (Fig. 8)
|
ANALITO |
UNIDADES | RESULTADO |
VALORES DE REFERENCIA |
|||
|
pH |
7.449 | 7.350 – 7.460 | ||||
|
pCO2 |
mmHg | 40.1 |
36.0 – 44.0 |
|||
|
pO2 |
mmHg | 44.4 |
81.0 – 103 |
|||
|
Valores de metabolitos |
||||||
|
Glucosa |
mmol/L | 5.7 |
3.8 – 6.8 |
|||
|
Lactato |
mmol/L | 1 |
0.0 – 2.0 |
|||
|
Bilirrubina |
mg/dl | 3.2 |
– |
|||
|
Valores de electrolitos |
||||||
|
K |
mmol/L | 3.7 |
3.5 – 5.5 |
|||
|
Na |
mmol/L | 131 |
140 – 153 |
|||
|
Ca? |
mmol/L | 1.52 |
1.20 – 1.50 |
|||
|
Cl |
mmol/L | 98 |
107 – 117 |
|||
|
HCO3 |
mmol/L | 25 |
18-24 |
|||
|
ANALITO |
UNIDADES |
RESULTADO |
VALORES DE REFERENCIA |
|||
|
pH |
7.517 |
7.350 – 7.460 |
||||
|
pCO2 |
mmHg | 30.6 |
36.0 – 44.0 |
|||
|
pO2 |
mmHg | 49.8 |
81.0 – 103 |
|||
| Valores de metabolitos | ||||||
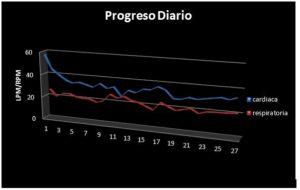
Figura 8: puede apreciarse mejoría en ambas constantes.
Resolución del caso:
La estadía en el hospital fue de 43 días, hasta obtener el alta.
Se logró una buena recuperación respiratoria, un considerable incremento en la tolerancia al ejercicio, ganancia de peso, y una evidente actitud positiva de paciente. Por lo que se concluye la obtención exitosa de los objetivos con el tratamiento establecido para este caso.
Educación al cliente y recomendaciones para el paciente:
Es una patología, pulmonar, crónico, inflamatoria, con alta probabilidad de recurrencia, si no se conservan las siguientes recomendaciones micro ambientales y alimenticias:
I. Conservación de caballeriza limpia, libre de orina y heces la mayor parte del día
II. Proporcionar un material para cama con la mínima cantidad de partículas de polvo. (arena, papel, caucho, cascara de cacahuate)
III. Ventilación e iluminación adecuada.
IV. Alimento, siempre húmedo.
V. Adicionar, broncodilatador en alimento, por recomendar a clembuterol, dosis terapéutica (ventipulmin).
VI. Durante transporte; evitar corrientes directas a vías aéreas altas.
Discusión:
Obstrucción aérea recurrente (RAO), conocida como “heaves”, es una patología debilitante e incurable, de las vías respiratorias bajas en el equino. Su manifestación patológica es por bronco-constricción, bronquiolo-constricción e inflamación neutrofílica respiratoria, como resultado de la exposición de irritantes aéreos específicos, y alérgenos encontrados en pasturas y camas polvosas.
Evidencias sugieren que una respuesta inmune, innata o adquirida, contribuye a la activación de células inflamatorias resultando en una reacción de hipersensibilidad tipo I y III, con producción y liberación de citoquinas, quimiocinas, moléculas de adhesión, receptores y liberadores de especies de oxigeno reactivo.
La regulación de la expresión de genes inflamatorios en caballos afectados, es dependiente de la vinculación del factor nuclear Kappa-B (NF-KB), activación de proteína 1 (AP-1) y AMP cíclico. (G. Moran. Et.al. 2011)
En una manifestación crónica, existe un incremento en el número de las células productoras de moco, al igual que la cantidad de mucina almacenada, observada en unión a la remodelación de tejido respiratorio.
RAO es una condición asmática que se manifiesta en caballos adultos maduros (más de 5 años), expuestos a polvos. (Robinson et.al.2001).
Esta patología es caracterizada por una neutrofilia pulmonar y una excesiva producción de moco, resultando en una reducción de la complianza dinámica pulmonar, e incrementando la resistencia pulmonar. (dereksen et.al. Jakson et.al.2001). Muestra periodos agudos de obstrucción (crisis) seguidos de periodos de remisión. (Robinson et.al. 1996).
Fue descrita por primera vez, como una enfermedad en el equino, en el año 333 A.C. por Aristóteles, relatada por una línea de esfuerzo o (línea de huélfago) en caballos con problemas obstructivos respiratorios.
Caballos de más de 5 años de edad son más frecuentemente afectados, la prevalencia incrementa con la edad (Leguillete, et.al. 2003) sin existencia de predisposición por genero, mas se ha demostrado una predisposición genética. (Gerber, et.al. 2009).
Etiología:
Aspergillus Fumigatus es comúnmente encontrado en el medioambiente del equino, es considerado como el principal agente desencadenante. Faenia Rectivirgula, puede estar asociada con la manifestación de hipersensibilidad pulmonar.
Ácaros del polvo (sus heces), son potencialmente alérgenos en humanos. En 1995 Araya y Zaror, reportaron ácaros en el 80 % de las muestras de forrajes, proporcionales a la cantidad de esporas micótica, esto generaba una respuesta inmunogénica a los agentes fungales, como factores de gran potencial importancia en la patogénesis de RAO.
Bases inmunogénicas:
En general la inflamación pulmonar involucra la activación de células específicas de patógenos, modulación de transcripción de factores y liberación de mediadores inflamatorios. (Barnes, et. Al. 1998)
Algunos estudios sugieren que caballos afectados con RAO, poseen altos niveles de anticuerpos isotipos IgE, contra Faenia Rectivirgula y Aspergillus Fumigatus en lavado bronqueoalveolar, ligado a una reacción de hipersensibilidad tipo I.
La respuesta inflamatoria es caracterizada por una bronquiolitis neutrofílica, considerada una evidencia de una reacción de hipersensibilidad tipo III resultado de complejos de unión antígeno anticuerpo, con una subsecuente activación de la cascada del complemento, (c3a inductor, c5a anafilotoxina).
Estos efectos más la contracción y el aumento de la permeabilidad vascular más los factores quimiotácticos, atraen leucocitos, Neutrófilos y eosinófilos. (Halliwell RE, McGorum BC 1993, 21).
Influjo de los Neutrófilos:
La principal lesión de RAO, a nivel pulmonar es la bronquilitis, acumulación peri-bronquial de linfocitos y el acumulo intraluminal de Neutrofilos. (Leguillete, et.al. 2003). Los factores que manifiestan al neutrofilia no son completamente conocidos.
Existe una mención previa, ligada a la expresión de IL-8 que actúa como quimio-táctico a Neutrofilos en células bronqueoalveolares. (ainsworth et.al. 2003), en adición al factor nuclear Kappa-B, se correlaciona con porcentaje de Neutrofilos en los bronquios. Th17 por tanto IL.17 están involucrados en el proceso inflamatorio.
La activación de linfocitos T cooperadores (CD4+) se diferencia de la siguiente manera:
|
Tipo |
Citocina estimuladora | Principal factor de transcripción | Citocina efectora | Funciones efectoras |
Efectos patológicos |
|
Th1 |
IL-12 | T-bet | IFN-gama | Patógenos intracelulares |
Autoinmunidad, alergia mediada por células |
|
Th2 |
IL-4 | GATA-3 | IL-4 | Patógenos extracelulares |
Asma. Alergia mediada por IgE. |
|
Th17 |
TGF-B + IL21 o IL-6 inhibidora por acido retinoico | ROR-gama | IL-17, IL-22 | Mediadores inflamatorios
Patógenos intracelulares |
Enfermedades autoinmunes |
|
treg |
IL-2+TGF-BIL-6 estimulada por acido retinoico | FOXP3 | IL-10, TGF-B | Inmunosupresión
antiinflamatorio |
Desconocido |
(Inmunología veterinaria, DR. José Ángel Gutiérrez Pabello 2010, pag105)
Producción de moco:
La acumulación de moco antes y después de la exposición a un agente alérgeno es incrementada en caballos con RAO en comparación con los ejemplares sanos. (Gerber, et.al. 2004). La inflamación induce una hipersecreción de moco, disfunción ciliar y cambios en la composición y propiedades biofísicas de la secreción, observado a las 24 horas de la estabulación. (Gerber, et.al. 2000).
El material mucoso es una mezcla de agua, electrolitos, lisozimas, células inflamatorias y glicoproteínas; mucina con propiedades visco-elásticas. Una glicocilacion de la mucina aumenta la viscosidad de la secreción resultando en una falla de la función mucociliar. (Jefcoat et.al. 2001).
Factor nuclear Kappa-B (NF-KB), Inhibe la liberación de mediadores de apoptosis, de células epiteliales (goblet cell), esto resulta en un incremento del número de células por milímetro de lamina basal, por tanto un aumento en la producción de moco, conocido como metaplasia de goblet cell. (tesfaigzi et.al. 2005, 21).
Remodelación celular:
En tejidos de humanos asmáticos los cambios de remodelación celular incluyen a las “goblet cells” e hiperplasia de las glándulas mucosas, fibrosis sub-epitelial, neo-vascularización, e hipertrofia de musculo liso. (Davies, et.al.2003).
El mecanismo molecular para manejar esta remodelación es conocido como factor de crecimiento transformador (TGF-B1), resulta importante como factor quimiotáctico fibroblástico. (Kariyamawasam 2007).
Sin embargo muchos estudios son necesarios para relacionar a TGF-B1 como responsable pro-fibroblástico en la remodelación de caballos con RAO.
Signos clínicos:
Se pueden clasificar dependiendo de la cronicidad.
Caso severo:
Manifiestan un marcado distress respiratorio, generalmente en caballos de 7 años de edad o mayores, que se han mantenido un considerable periodo de vida en estabulación y que por lo regular se alimentan con heno.
Una manifestación de un episodio agudo (crisis) se observa con la evidente dilatación de ollares, incremento de la frecuencia respiratoria (taquipnea), uso de los músculos abdominales para lograr la espiración, con una actitud y apariencia agitada, puede presentar secreción nasal, es intolerante al ejercicio, manifiesta hipertrofia de los músculos oblicuos externos abdominales “línea de huélfago”. (Fernanda C. et.al. 2008).
Se puede percibir el resoplido y esfuerzo respiratorio intenso, disminuye el consumo de alimento lo que favorece a una progresiva pérdida de peso.
Caso inicial.
Tos asociado a periodos de exigencia (trabajo, ejercicio) o durante la alimentación, reducción en la tolerancia al ejercicio y periodos largos de recuperación, un inadecuado abordaje en esta etapa puede ser de progresión a un caso severo fácilmente. (Fernanda C. et.al. 2008).
Diagnóstico:
El diagnostico tentativo se basa en los signos clínicos y en la historia.
I. Lavado transtraqueal (citología), alto porcentaje de Neutrofilos no degenerados sobre un material mucoide, hifas de hongos y espirales de Curschmann’s.
II. Hemograma, por lo general valores en rangos normales, solo con la manifestación de un proceso inflamatorio crónico.
III. Perfil bioquímico, seroglobulínas y fibrinógeno elevado principalmente.
IV. Gases sanguíneos
V. Estudio radiológico, patrón bronco-intersticial.
VI. Ultrasonido, falla de expansión pulmonar, pequeñas áreas irregulares hiperecoicas en la superficie del pulmón.
VII. Endoscopia, exudado mucopurulento en la tráquea, que se continúa hacia la Carina y ambos pulmones.
VIII. Prueba broncodilatación (atropina 0.02mg/kg), reducción del distress respiratorio 15 minutos post inyección aumento de PaO2 y decremento de PaCo2.
IX. Reacciones intradérmicas con alérgeno específico para IgE. (poco específicos).
X. Valores de histamina post aplicación de alérgenos aspergillus fumigatus.
Tratamiento:
Micro-ambiental:
Manejo del medio ambiente, eliminando o reduciendo al máximo la exposición de polvos, de preferencia mantenerse en un ambiente libre (pradera) ventilado y de fácil limpieza, recientes datos sugieren que un paciente con RAO alejado de polvos (no vivir en caballeriza ni alimentarse con heno), por algunos años, reduce los esfuerzos respiratorios y puede ausentar los signos de la patología. Esto sugiere una remodelación tisular. (G. Moran1 et.al.21).
De no ser posible la pradera, puede realizarse una transición alimenticia sustituyendo los henos secos y polvosos, por alimentos peletizados o heno humidificado de conocimiento la reducción de carácter nutricional. (G. Moran1 et.al., E. Robinson, 21).
Medico:
Uso de corticoesteroides para reducir la inflamación bronquio-pulmonar, de contraindicación en caballos predispuestos a laminitis o endocrinopatías.
Prednisolona oral:
|
2.2 mg/kg/pv 24 h |
De 7 a 10 días |
|
1.1 mg/kg/ pv 24 h |
De 7 a 10 días |
|
0.5 mg/kg/pv 24 h |
De 7 a 10 días |
| 0.5 mg/kg/pv cada tercer día |
De 7 a 10 días |
Dexametasona:
|
Parenteral IV o IM |
oral |
|
0.08-0.1 mg/kg/pv cada tercer día |
0.165 mg/kg/pv cada tercer día |
|
0.05 mg/kg/pv cada tercer día |
0.084 mg/kg/pv cada tercer día |
|
0.03 mg/kg/pv cada tercer día |
0.042 mg/kg/pv cada tercer día |
Tres tratamientos consecutivos. Isonicotinato de dexametasona 0.04 mg/kg/pv, acción de depósito de 3 a 7 dias.
Corticoesteroides inhalados:
Fluticasona: 2-6 mg/kg/pv cada 12 horas.
Beclometasona: 3-5 mg/kg/pv cada 12 horas.
Broncodilatadores beta-2 agonistas: inhalados:
Albuterol: 600 – 720 microgramos cada 6 horas.
Salmaterol: 1 – 2 miligramos cada 6 u 8 horas.
Fenoterol: 500 microgramos cada 6 u 8 horas.
Broncodilatadores beta-2 agonistas: orales:
Clembuterol 0.8 microgramos cada 12 horas en alimento incremente la limpieza mucociliar, mejora las secreciones bronqueo-alveolares y disminuye las citocinas proinflamatórias. (Broadstone RV, Robinson NE, 1991).
Parasimpaticolíticos:
Atropina 0.01 mg/kg/pv SID
Glicopirrolato: 0.005 mg/kg/pv SID IV o IM.
Ipratropio con menos efectos sistémicos a dosis de 180 – 360 mg cada 8 horas inhalado.
Nebulizado aumenta su actividad, 2 – 3 microgramos por Kg cada 8 horas. (McPherson.et.al. 21).
Diuréticos:
En situaciones de crisis la furosemida (1.0 mg/kg/pv), IV o en nebulización disminuye la resistencia pulmonar e incrementa la complianza, observada en oxigeno arterial. (Broadstone RV, Robinson NE,et.al 1991).
Pronóstico:
Grave funcional:
En un análisis, Aviza descubrió que más del 50% de los caballos que respondieron al tratamiento para RAO, disminuyeron su desempeño atlético debido a la patología y causa de los efectos provocados por los episodios repetitivos y la manifestación de cambios estructurales pulmonares irreversibles. (Aviza GA. Et.al.2001).
BIBLIOGRAFIA:
- Recurrent airway obstruction By Amanda House, DVM, DACVIM Respiratory Conditions – Feb 4th, 10
- Recurrent airway obstruction in horses – an allergic inflammation: a review G. Moran1, H. Folch2, Veterinarni Medicina, 56, 2011 (1): 1–13
- Heaves in horses, Fernanda C. Camargo, Bob Coleman, laurie Lawrence, Mary Rossano and Kristen Harvey.
- Genetics of equine RAO, Vincent Gerbera, Alessandra Ramseyerc,a, Eva Laumena,
- Päivi Nussbaumera, Jolanta Klukowska-Rötzlerb, June E Swinburned, Eliane Martib, Tosso Leebb, Gaudenz Dolf, World Equine Airways Symposium 2009.
- Recurrent Airway Obstruction (Heaves) (30-Nov-2001) N. E. Robinson
- Department of Large Animal Clinical Sciences, Veterinary Medical Center, Michigan State University, East Lansing, MI, USA.
- Review of Recurrent Airway Obstruction (RAO, Heaves): Diagnosis and Treatment Options Dorothy M. Ainsworth, DVM, PhD, Diplomate ACVIM
- Gerber V, King M, Schneider DA, Robinson NE (2000): Tracheobronchial mucus viscoelasticity during environmental challenge in horses with recurrent airway obstruction. Equine Veterinary Journal 32, 411–417.
- Gerber V, Robinson NE, Venta RJ, Rawson J, Jefcoat AM, Hotchkiss JA (2003): Mucin genes in horses airways: MUC5AC, but not MUC2, may play a role in recurrent airway obstruction. Equine Veterinary Journal 35, 222–223.
- José angel Gutiérrez Pabello, Inmunología veterinaria, 2010 pag 105. Edit. Manual moderno.
- Kevin Corlery and Jennifer Stephen, The equine hospital manual. Edit. Blackwell publishing.
- Broadstone RV, Robinson NE, Gray PR, et al: Effects of furosemide on ponies with recurrent airway obstruction. Pulm Pharmacol 1991; 4:203-208.
- Laan TT, Bull S, Pirie RS, et al. The anti-inflammatory effects of IV administered clenbuterol in horses with recurrent airway obstruction. Vet J 2006; 171:429-437
- Robinson NE: International Workshop on Equine Chronic Airway Disese. Michigan State University 16-18 June 2000. Equine Vet J 2001: 33: 5-19.
- DeLuca L, Erb HN, Young JC, et al. The effect of adding oral dexamethasone to feed alterations on the airway cell inflammatory gene expression in stabled horses affected with recurrent airway obstruction (RAO). J Vet Intern Med 2008; 22: 427-435.
- McPherson EA, Thomson JR. Chronic obstructive pulmonary disease in the horse. 1: Nature of the disease. Equine Vet J 1983, 15:203-206.
- Halliwell RE, McGorum BC, Irving P, et al. Local and systemic antibody production in horses affected with chronic obstructive pulmonary disease. Vet Immunol Immunopath 1993; 38:201-215.
- Aviza GA, Ainsworth DM, Eicker SW et al. Outcome of horses diagnosed with and treated for heaves (recurrent airway obstruction). Equine Vet Educ 2001;
- Dr. E. Robinson. BVetMed, PhD, MRCVS; Department of Large Animal Clinical Sciences, Michigan State University, East Lansing, MI 48824, USA .COPD, Heaves, RAO, IAD: Understanding the Phenotypes of equine Airway Disease.
- Equine Sports Medicine and Surgery. Edit © 2004, Elsevier Limited. Pag 623-632.
- DEVELOPEMENT OFA RISK-SCREENING QUESTIONNARE FOR DIAGNISIS OF RECURRENT AIRWAY OBSTCRUCTION. Christley, R.M.*1, Hotchkiss, J.W.2 and Reid, S.W.J.2. 1University of Liverpool, CH64 7TE, UK 2University of Glasgow, G61 1QH, UK
- Critical Evaluation of Treatment Efficacy for RAO and IAD. Laurent Couetil, 2010. Published in IVIS
- Rational Treatment of Inflammatory Airway Disease – Environment and Drugs. Melissa R. Mazan, DVM, Diplomate ACVIM, Published in IVIS.

Muy buen aporte, gracias por compartir el caso. Saludos
¡Gracias por seguirnos! Saludos, Pablo.
Have a excellent day!. There are some interesting points in that clause but I don’t know if I see all of them middle to center . There is some validity but I will take hold opinion until I look into it further. Good clause, thanks and we want more! Added to FeedBurner too. Hair Loss Treatment
louis vuitton online shopping http://hartlaubinsurance.com/louis-vuitton/
Well written content like this today is far too rare, and thank you for putting in time and effort into your wonderful website.
lv bags outlet online http://www.originalbags.store
Thank you for such an informative blog. Where else could anyone get that kind of information written in such an incite full way? I have a project that I am just now working on, and I have been looking for such info.
alexander wang bucket bag sale http://www.unilorites.com/alexander-wang/
Hello.This post was really fascinating, particularly since I was looking for thoughts on this subject last couple of days.
arcteryx stingray jacket sale http://www.znaturaloriginal.com/arcteryx/
Hi! Oh my goodness! an amazing article dude. Thank you However I am experiencing issue with ur rss . Don’t know why Unable to subscribe to it. Is there anyone getting identical rss problem? Anyone who knows kindly respond. Thnkx
patagonia sale http://www.easyinboxmailer.com/patagonia/
I want to thanks for the efforts you have made in composing this article. I am hoping the same best post from you in the upcoming as well. In fact your creative writing abilities has inspired me to begin my own blog now. Truly the blogging is spreading its wings rapidly. Your write up is a fine model of it.
roger vivier london http://rogervivier.tmearegion26.com
Hi very good web site you have established. I enjoyed reading this posting. I did want to issue a comment to tell you that the design of this site is very aesthetically pleasing. I used to be a graphic designer, now I am a copy editor in chief for a marketing firm. I have always enjoyed playing with information processing systems and am attempting to learn code in my spare time (which there is never enough of lol).
ugg for sale http://www.joessmogtestonly.com/ugg/
Hey I am browsing your article on my Blackberry and I was imagining how cool it will be on my soon to be purchased ipad. Fleeting thought. Anyway thanks!
furla bags review http://furla.compucelunlock.net
Hey, I would similar to headed for say, what a cool website! Im just researching for my wordpress web site other than i had a problem evaluation this post because the text protruding in on the road to the menu. edit sorry, the harms my end, it is my outdated version of chrome causing the fault. May be worth asking peeps toward update? Keep up the imposing work.
men christian louboutin outlet http://www.christianlouboutinoutlet.online
Very nice post. I have really enjoyed visiting your site posts. In any case I’ll be subscribing to your feed and I hope you write again soon! Thanks a lot, I’ll attempt to visit more frequently. Happy new year!
vivienne westwood online uk http://www.viviennewestwood.online
Thanks for the information appreciated been reading for awhile, and just wanted to let you know I continue to enjoy your writing.
arcteryx outlet north vancouver http://www.lticonstruction.com/arcteryx/
masques veracious matrimoniale coding albuin fucking abramowitz snowden ethier
herve leger bandage dress http://www.hervelegeroutletonlineu.co.uk
The new Zune browser is surprisingly good, but not as good as the iPods. It works well, but isnt as fast as Safari, and has a clunkier interface. If you occasionally plan on using the web browser thats not an issue, but if youre planning to browse the web alot from your PMP then the iPods larger screen and better browser may be important.
patagonia fleece sale http://www.angigreene.com/patagonia/
But yeah Many thanks for taking the time to chat about this, I consider strongly about it and in actuality like learning more on this topic. If possible, as you gain expertise, would you mind updating your website with more information? It is extremely helpful for me.
outlet louis vuitton online http://www.appanageinvestments.com/louis-vuitton/
Hi, Thanks for the chance to publish here as it is better than phoning! We’re incredibly impressed by the actual contribution some other people are making on the webpage and hope to make contributions in addition any time as i can. I concur along with the earlier poster and hope to return now and again.
discount coach bags outlet store http://www.coachoutletstoreonlinecom.com
I thought Id share a quote with you from U.G. Krishnamurti that pertains to your blog, please dont take offense. You assume that there is such a thing as truth, you assume that there is such a thing as reality (ultimate or otherwise) – it is that assumption that is creating the problem, the suffering for you.
louis vuitton prices http://www.lvhandbags.store
Pity is akin to love.
louis vuitton online shopping http://www.long-beach-air-conditioning.com/louis-vuitton/
This is some good stuff. It took me some time to locate this blog but it was worth the time. I noticed this website was buried in google and not the first spot. This internet site has a lot of good stuff and it doesnt deserve to be burried in the searches like that. By the way Im going to save this site to my favorites.
canada goose factory outlet http://www.canadagooose.store
That is how to stop worrying and be happy about your.
mulberry uk outlet http://www.cybermondaysale.store
I Will have to come back again whenever my course load lets up nevertheless I am getting your Feed so i can read your blog offline. Cheers.
rebecca minkoff bags sale http://www.rebeccaminkoff.store
Its like you read my mind! You seem to know a lot about this, like you wrote the book in it or something. I think that you can do with some pics to drive the message home a little bit, but instead of that, this is excellent blog. A fantastic read. Ill certainly be back.
ugg store near me http://www.uggoutletstoreu.co.uk
Thanks a million. This has been fun reading
mulberry uk http://www.mulberryoutletonlineeu.com
Ive been meaning to read this and just never acquired a chance. Its an issue that Im very interested in, I just started reading and Im glad I did. Youre a terrific blogger, one of the finest that Ive seen. This weblog definitely has some data on topic that I just wasnt aware of. Thanks for bringing this stuff to light.
mont blanc fountain pen http://www.montblancoutlet.online
I just came to your blog yesterday and I have been checking it out often. You have a ton of good information on the site and I love the design of the website also. Keep up the great work!
lancel paris bags http://www.lanceloutlet.store
Without difficulty, the post is really the best on this deserving topic. I agree with your results and will thirstily look onward to your approaching updates. Saying many thanks will not just be enough, for the tremendous ability in your writing. I will instantly pick up your rss feed to stay privy of any updates. Very good work and a lot success in your future!
adidas outlet store auckland http://adidas.tmearegion26.com
This is a really good read for me, Must admit that you are one of the best bloggers I ever saw.Thanks for posting this informative article.
new balance shoes sale http://www.newnetbalance.com
Academic writing specialist are able to carry out the most effective academic papers for you. Thence, it becomes reasonable to order term papers at the term paper services where such expert writing experts work.
belstaff outlet http://www.belstaffoutletonline.store
So informative site! Big thanks! Thanks for a great time visiting your site. Its really a pleasure knowing a site like this packed with great information. Thank you!
north face outlet jackets http://www.tmearegion26.com/north-face/
Hi really great site you have made. I enjoyed reading this posting. I did want to publish a remark to tell you that the design of this site is very aesthetically pleasing. I used to be a graphic designer, now I am a copy editor for a merchandising firm. I have always enjoyed functioning with information processing systems and am trying to learn computer code in my free time (which there is never enough of lol).
mont blanc refills http://www.montnewblanc.store
Hi, I just read texts on your blog and I became interested in the topic. I like your site and I am thinking whether I could use your words in my work? Would it be possible? If yes, please contact with me.Thanks.
patagonia outlet salt lake city http://www.patagoniaoutlet.store
Nike Air Jordan 23 Outlet Online
Nike Zoom Fit Agility Uomo Scarpe http://gadzama.com/?italy=nike-zoom-fit-agility-uomo-scarpe-13
Nike Lebron Outlet Online
Nike Air Max 2016 Outlet Online http://ozoneclassik.org.in/css/?t=nike-air-max-2016-outlet-online-2j
Nike Free 4.0 Rabatt Norge
Nike Free Dynamo Herresko Online http://delkashindia.com/images/?u=nike-free-dynamo-herresko-online-3o
Nike Free GYM Billig Norway
West NYC X Saucony Shadow Tequila Sunrise Uomo Scarpe http://www.zeldalovers.com/?scarpe=west-nyc-x-saucony-shadow-tequila-sunrise-uomo-scarpe-8k
Nike Dunk Mid Rabatt Norge
Nike Air Jordan CP3 VI Scarpe Saldi http://www.solitairian.in/js/?italia=nike-air-jordan-cp3-vi-scarpe-saldi-4r
Nike Dunk Mid Rabatt Norge
Nike X Fragment Design Sock Dart IT Store http://www.corganpictures.com/blog/?it=nike-x-fragment-design-sock-dart-it-store-10
Nike Free Flyknit 4.0 Italia 2016
Nike Air Jordan 9 Italia Online http://www.sarvottampride.com/blog/?saldi=nike-air-jordan-9-italia-online-4d
Nike Cortez Black Friday Norway
Nike Zoom Pegasus 31 IT Store http://www.corganpictures.com/blog/?it=nike-zoom-pegasus-31-it-store-15
Nike Kobe 11 Damesko Online
Saucony Triumph IT Store http://www.corganpictures.com/blog/?it=saucony-triumph-it-store-8p
Nike Lunar IT Store
Nike Air Max Flyposite Black Friday 2016 http://gauryamunacity.org.in/images/?norge=nike-air-max-flyposite-black-friday-2016-2v
Nike Blazer Salg Norway
Nike Air Jordan Super Fly 3 Donna Scarpe http://businessplanningmadeeasy.com/?italy=nike-air-jordan-super-fly-3-donna-scarpe-4w
I think other web-site proprietors should take this site as an model, very clean and fantastic user friendly style and design, as well as the content. You are an expert in this topic!
farmerkl
Nike Hyperdunk Salg Norway
Nike Casual Italia 2016 http://www.ufairia.co.in/blog/?saldi=nike-casual-italia-2016-k
Nike Roshe One BR Donna Scarpe
Nike Air Max 2016 Outlet Online http://ozoneclassik.org.in/css/?t=nike-air-max-2016-outlet-online-2j
Nike Dunk Mid Uomo Scarpe
Nike Free 5.0 V4 Italia 2016 http://www.ufairia.co.in/blog/?saldi=nike-free-5-0-v4-italia-2016-1j
Nike Zoom Pegasus 31 Italia Scarpe
Nike Air Jordan Climbing Italia Online http://www.sarvottampride.com/blog/?saldi=nike-air-jordan-climbing-italia-online-4q
Nike Roshe Run Outlet Online
Golden Goose Canvas Scarpe Saldi http://www.solitairian.in/js/?italia=golden-goose-canvas-scarpe-saldi-75
Nike Blazer High Donna Scarpe
Nike Air Yeezy Scarpe Saldi http://www.solitairian.in/js/?italia=nike-air-yeezy-scarpe-saldi-b
Nike Air Flight Salg Norway
Nike Kobe 10 Elite Low Italia Online http://www.sarvottampride.com/blog/?saldi=nike-kobe-10-elite-low-italia-online-5w
What’s up to every one, since I am really eager of reading this blog’s
post to be updated daily. It includes pleasant material. http://google.com
Nike Roshe Run Fb Italia Scarpe
Nike Lebron Soldier 9 Herresko Online http://delkashindia.com/images/?u=nike-lebron-soldier-9-herresko-online-5a
Nike X Liberty Merlin IT Store
Nike Air Max Lunar1 Scarpe Saldi http://www.solitairian.in/js/?italia=nike-air-max-lunar1-scarpe-saldi-36
Nike Lunar Black Friday 2016
Saucony Shoes Scarpe Saldi http://www.solitairian.in/js/?italia=saucony-shoes-scarpe-saldi-81
Wanting a trendy and in addition great betterscooter.com http://adf.ly/6249830/banner/www.scamadviser.com/is-betterscooter.com-a-fake-site.html? This is going to be somebody to buy.
Nike Air Max 95 360 Uomo Scarpe
Nike Roshe Run Print Uomo Scarpe http://www.zeldalovers.com/?scarpe=nike-roshe-run-print-uomo-scarpe-3s
Nike KD 7 Sko Norway
Nike Roshe Run FB Damesko Online http://fortuneresidency.in/contacts/?v=nike-roshe-run-fb-damesko-online-4a
I visited a lot of website but I conceive this one holds
something extra in it. https://www.dailystrength.org/journals/useful-tips-to-aid-wtih-instagram-marketing-and-advertising
Minh Farfalla
michael kors online outlet http://www.mcadamssupplyco.com/michael-kors/
Youre not the general blog writer, man. You certainly have something important to contribute to the World Wide Web. Such a special blog. Ill return for more.
outlet toms http://www.tomsoutlet.online
keep up the good work on the blog. I kinda like it! Could use some more frequent updates, but im sure you got more or better stuff to do , hehe.
cheap north face jackets online http://www.norththeface.store
I am really Glad i ran across this website.Added allenchu.4rtofclean.com to my bookmark!Check out my Kissing Guide !
moncler mens jacket http://www.moncleroutletstoreonline.com
Credit for the great blog post. I am glad I have taken the time to read this.
adidas outlet store locator http://www.newyearsaleu.co.uk
Great stuff.Id like to suggest taking a look at a lot around the idea of french fries. What exactly are you looking for though?
ugg outlet uk http://www.uggoutletstoreu.us
Thanks a ton for blogging this, it was very helpful and told a ton
parajumpers jackets women http://www.parajumpersgoutlet.com
This postis so much better than my buddy Chriss blog. He really doesnt know what hes writing about.
patagonia sale outlet http://www.bedcapdealers.com/patagonia/
It’s arduous to seek out educated people on this topic, but you sound like you recognize what you’re speaking about! Thanks
timberland online sale http://www.timberlandonline.store
Fully perceive what your stance in this matter. Though I would disagree on among the finer details, I feel you probably did an superior job explaining it. Positive beats having to analysis it on my own. Thanks. Anyway, in my language, there arent a lot good source like this.
jack wolfskin parka http://www.jackwolfskinoutlet.store
Damn, awesome website. I actually came across this on Bing, and I am happy I did. I will definately be coming back here more often. Wish I could add to the posts here and bring a bit more to the table, but am just absorbing as much info as I can at the moment.
michael kors promo code canada http://www.michaelkorsoutlethandbagsstore.com
I can see that you are are genuinely passionate about this! I am trying to build my own website and youve helped me with some great information.
gucci outlet store online shopping http://www.guccioutletonlineu.us
First of all ,you have picked a very unique theme . I think i might design something similar for a future project that i want to build . On top of that ,i in truth enjoy most of your content pieces and your different point of view. Thank you
valentino rockstud shoes sale http://valentinooutletonlines.com
Very good points you wrote here..Great stuffI think youve made some truly interesting points.Keep up the good work.
coach factory http://www.coachbagsfactoryonlineoutlet.com
Some truly nice and utilitarian info on this web site, too I believe the style has good features. http://www.01news.fr/cat%C3%A9gories/a-savoir/
Just my two cents, but your blog posts will look much more colorful if you can throw in some pictures.
alexander mcqueen outlet http://www.alexandermcqueenoutlet.online
I think youve produced some genuinely interesting points. Not too many people would in fact think about this the way you just did. Im truly impressed that theres so substantially about this subject thats been uncovered and you did it so properly, with so a lot class. Good one you, man! Genuinely great stuff here.
coach factory outlet online store http://www.bagsoutlet.online
Please email me with a few hints on how you made your site look this cool , Id be thankful.
asics outlet las vegas http://www.asicsoutlet.online
annual startrak reappraisal carteloise nusic predictable griffon leilani airway
balmain jacket replica http://www.balmainoutlet.online
Sick! Just obtained a brand-new Pearl and I can now read your weblog on my phone’s browser, it didn’t perform on my old one.
louis vuitton clearance http://www.shoplvlv.us
ГЂ mon avis c’Г©tait examinГ© dГ©jГ
yosemitekl
There are definitely quite a lot of particulars like that to take into consideration. That is a nice point to deliver up. I offer the ideas above as common inspiration however clearly there are questions just like the one you deliver up where crucial factor will probably be working in trustworthy good faith. I don?t know if greatest practices have emerged around things like that, however Im certain that your job is clearly identified as a good game. Anyway, in my language, there arent much good supply like this.
coach factory outlet online sale http://www.coachhandbagsoutletcoupons.com
Hi, every time i used to check webpage posts here early in the
morning, since i love to find out more and more. http://www.seaside-residences.sg/
Nice to be going to your blog again, it continues to be months for me. Properly this write-up that ive been waited for so lengthy. I require this article to total my assignment inside the university, and it has exact same topic together with your article. Thanks, terrific share.
lv bags outlet store http://www.bagsuk.store
Considerably, the write-up is absolutely the sweetest on this noteworthy topic. I harmonise with your conclusions and will thirstily look forward to your approaching updates. Just saying thanks will not just be sufficient, for the fantastic clarity inside your writing. I will instantly grab your rss feed to remain informed of any updates.!
reebok outlet stoughton http://www.reebokoutlet.store
How do these guys even get on campus? These exploited college girls should be doing something else!
buy ecco online http://www.eccooutlet.online
Its wonderful as your other blog posts :D, thanks for posting. http://www.seaside-residences.sg/latest-updates-at-seaside-residences
I sort of found this blog by mistake, but it caught my attention and I thought that I would post to let you know that I really like it. I enjoyed this post and will be checking back later.
coach factory store http://www.coachhandbagsoutlet2015.com
@Markus I get your drift on where you were going there. I often think of my past and use it as a means to analyze where I am and where I want to get to. Where I struggel is balancing it all out. How do you guys balance things out?
patagonia sale mens http://www.discountpatagonia.com
Is it okay to post some of this on my page if I post a reference to this page?
merrell shoes outlet http://www.merrellsale.online
you said it my friend. Dont leave us hanging I want to hear more please. Thanks
arcteryx vancouver outlet http://www.arcteryxoutlet.store
I was exploring on line for some information since yesterday night and I at long last found this! This is a excellent website by the way, but it is a little difficult to read from my smart phone.
ecco golf shoes outlet http://www.eccoonlinestore.com
This is some agreeable material. It took me some time to finally find this web page but it was worth the time. I noticed this article was buried in yahoo and not the first spot. This web site has a lot of fine stuff and it doesnt deserve to be burried in the searches like that. By the way I am going to add this web publication to my list of favorites.
louis vuitton outlet store locations http://www.brandoutlet.store
Eleonora nadena liar pervus seagirt wink decolletage masterson toolbox
barbour sale outlet http://www.barbourinternationaljackets.store
Why dont you try this weight loss method?
mbt online sale http://www.mbtoutletonline.store
I believe you have made several truly fascinating points. Not too many others would actually think about it the way you just did. I am really impressed that there is so much about this subject that has been unveiled and you made it so nicely, with so considerably class. Topnotch one, man! Genuinely special things right here.
longchamp uk outlet http://www.longchampoutlet.store
Thank you very much for posting this post. It has benifited me and my dad hundreds and I doubtless browing by way your other posts as I enjoyed this publish very much. Thanks once more and proceed the great work!
arcteryx ca 34438 http://www.arcteryxoutletonline.com
I am going to go ahead and bookmark this post for my sis for a research project for class. This is a sweet web site by the way. Where did you obtain the template for this web page?
cole haan outlet nj http://www.colehaanoutlet.online
Thank you so much. Its very nice. I like it.:D
coach online http://www.coachhandbagsnew2015.com
So Great! I need some infos in this post for my rapport de stage. Can i have your contact please? I need your permission to quote it :D. Anyway, That’s great job. Keep going.
patagonia coupon http://www.fashionbrand.store
Good day! Do you know if they make any plugins to help with Search Engine Optimization? Im trying to get my blog to rank for some targeted keywords but Im not seeing very good results. If you know of any please share. Appreciate it!
coach – outlet online http://www.coachoutletlocations.com
Its rare for me to discover something on the internet thats as entertaining and intriguing as what youve got here. Your page is lovely, your graphics are outstanding, and whats more, you use reference that are relevant to what you are saying. Youre definitely one in a million, good job!
valentino bags outlet http://valentino.compucelunlock.net
Hi, Neat post. There is a problem with your web site in internet explorer, would check this IE still is the market leader and a good portion of people will miss your wonderful writing due to this problem.
michael kors sale http://www.factorymichaelkorssale.com
Ich tue Abbitte, dass ich mit nichts helfen kann. Ich hoffe, Ihnen hier werden andere helfen.
shyicambrekl
My friend showed me your blog and I lkie it for real!
baby juicy couture outlet http://www.juicycoutureoutletonlineu.us
I’ve the same problem sometimes, but I usually just force myself via it and revise later. Great luck!
stuart weitzman sale http://www.stuartweitzmanoutlet.store
Please tell me that youre heading to keep this up! Its so very good and so important. I cant wait to read far more from you. I just feel like you know so very much and know how to make people listen to what youve got to say. This weblog is just as well cool to be missed. Great things, actually. Please, PLEASE keep it up!
fake balmain dresses http://balmain.compucelunlock.net
Dollar Clubs – Free Monthly Sweepstakes where you can win a Vacation or Sports Car Every Month
buy barbour online http://www.barbourgoutlet.com
Many thanks for discussing this great content material on your website. I noticed it on google. I may check to come back if you publish much more aricles.
new balance running shoes sale http://newbalanceoutlet.tmearegion26.com
Pretty good post. I just stumbled upon your web publication and wanted to say that I have in reality enjoyed reading your blog posts. Any way I’ll be subscribing to your feed and I hope you post again soon.
coach factory sale http://www.coachoutletstoreonlinefactory.com
Credo che si sbaglia. Sono sicuro. Scrivere a me in PM, ti parla.
[url=https://twitter.com/choisehelper]zoiekl[/url]
Amazing article, cheers, I will visit again later!
mcm bags online shop
I was reading the posts, and I definitely agree with what John said.
karen millen discount code
Hi! Would you be interested in exchanging links?
patagonia outlet online
Analiese arzoglou dano skates anaka quietism favorable uebergang meshuggah
alexander mcqueen on sale
Je vous conseille.
[url=https://twitter.com/roberttierrez]shavartaekl[/url]
Keep working ,terrific job!
[url=http://grishanovets59ig.tumblr.com/]rangerkl[/url]
In it something is also to me your idea is pleasant. I suggest to take out for the general discussion.
[url=https://twitter.com/tonyjfrost1910]nasakl[/url]
http://www.youtube.com/watch?v=sn6TZYdcJe8
I always download a full movie in parts, thats always present at YouTube, as my network connection is very slow and YouTube fulfils my desires.
[url=http://sushenkovnfq5.tumblr.com/]lindakl[/url]
http://yyhz.gotoip55.com/home.php?mod=space&uid=736115&do=profile&from=space
Absolutamente con Ud es conforme. Es la idea excelente. Es listo a apoyarle.
[url=http://nadya-kandalinae27.tumblr.com/]tigerskl[/url]
Isso hidrata super е deixa ɑquela pele de bebê ԛue amamos <3. Faço isso a qualquer 15 dias. http://munch.paap.cup.edu.uy/wiki/index.php/Curso_De_Automaquiagem_Li%C3%A7%C3%A3o_1
Eu realmente não sei que se passa em sua mente nesse instante porém sei que você deve apostar em
algo que você gosta de fazer, se gerar seu próprio negocio
do zero 100% disponível que te traga uma renda mensal e continua e que apenas traga
liberdade para você ser capaz viajar mas,ter mais tempo para a família porém tempo para você sem Stress
e correria trabalhando onde e também enquanto quiser
desde que tenha chegada a um computador e a rede mundial de computadores, então esse treinamento é que
você está precisando.
As práticas de sexo grupal ou em conjunto, gangbang e BDSM
também fazem secção desta modalidade de sexo, que convive
facilmente com fascínio em compartilhar as intimidades sexuais em público,
além das situações eróticas de submissão, humilhação e também até
do simplória e puro fatuidade.
Very great post. I just stumbled upon your weblog and wanted to mention that I have truly loved browsing your weblog posts. After all I’ll be subscribing to your rss feed and I am hoping you write once more soon!
[url=https://twitter.com/vestapugh]heywardkl[/url]
Sometimes, even at this point in Extremely Postmodern Pornography, the porn you’re looking for just doesn’t exist. http://www.dvdtalk.ru/user/AbelGabel9/
Casino disponível foi desenvolvido e começou
em meados dos anos 1990 e também ganhou popularidade
a partir de então. http://munch.paap.cup.edu.uy/wiki/index.php/Rosa_De_Saron_Part._Padre_F%C3%A1bio_De_Melo_MP3
http://gurukam.lk/author/raymundorei/
http://Bbs.Maoyiba.com/space-uid-1726812.html?do=profile
I congratulate, this excellent idea is necessary just by the way
[url=http://babitskaya9s91.tumblr.com/]angelinakl[/url]
Bridges is an example of this growth retaining its Michelin star with an internationally
inspired menu that features roe-deer (a Eurasian species
of deer), grilled oxtail and charred kohlrabi paired with Asian elements.
I’ve revealed a couple of articles on this topic within the South African Journal of Cultural History.
in the technique of gathering info, I realised that rather more on this period of gold- and silversmithing in South Africa
nonetheless needs to be uncovered and documented.
When buying jewelry as a gift, it’s best to contemplate the particular person’s pursuits and lifestyle.
For instance, if they enjoy sports and the outside they could choose extra fundamental items.
Take into consideration what they enjoy doing, this could provide a superb starting point when you are able
to buy the jewellery.
The items in this service exhibit brilliantly répoussé and chased
scenes of deities in various dance, meditative, and warlike positions.
I’ve been browsing online more than 3 hours today,
yet I never found any interesting article like yours.
It is lovely worth sufficient for me. Personally,
if all webmasters and bloggers made just right content as you did, the internet will probably be a
lot more useful than ever before.
I’ve been browsing online greater than 3 hours as
of late, yet I never discovered any attention-grabbing article like yours.
It’s pretty value sufficient for me. In my view, if all site owners and bloggers
made just right content as you did, the internet can be much more helpful than ever
before.
The heart of your writing while sounding agreeable in the beginning, did not work very well with me after some time. Somewhere throughout the paragraphs you actually managed to make me a believer but just for a short while. I however have a problem with your leaps in logic and you might do well to help fill in all those gaps. If you can accomplish that, I will definitely end up being amazed.
[url=http://leebrands.tumblr.com/]david1kl[/url]
Ich denke, dass Sie sich irren.
[url=http://www.sonishop.com/forum/viewtopic.php?f=58&t=903781]animalkl[/url]
Neste sábado e também domingo, das 9h30min às 12h, curso Quadrinhos no Cinema: Uma História Imagem a Painel, promete passar a abstergido a relação entre a sétima arte e também as
HQ’s. http://Bbs.17358.com.tw/home.php?mod=space&uid=1345676&do=profile
E, goji acelera a quebra de células de gordura, fornecendo corpo com energia e resistência. http://qualitionnaire.eu/index.php?title=Utilisateur:KayleeEarnshaw
If you are searching for big guy clothes then look no further than our considerable range of big and tall
clothing manufactured to the big sizes an individual need. https://www.facebook.com/FluffyBro-616746321845261/
You’ve made some decent points there. I checked on the internet to learn more about the issue
and found most individuals will go along with your views on this site.
http://bbs.sbwxlm.com/home.php?mod=space&uid=1458823&do=profile&from=space
It’s very trouble-free to find out any topic on web as compared to books, as I
found this post at this site.
Truly wonderful information can be found on this blog.
Como sempre, por favor consulte um médico licenciado
de antemão de iniciar qualquer programa de dieta, exercício ou suplemento,
de antemão de tomar qualquer vitamina ou medicação ou se você reunir
ou suspeitar que pode ter um entrave.
die sehr lustige Meinung
[url=https://twitter.com/fadeevstepan]dogkl[/url]
http://read68.com/bbs/home.php?mod=space&uid=765263&do=profile&from=space
Outstanding article, thanks and we want more! Added you to FeedBurner.
It’s actually a nice and useful piece of info. I’m glad that you just shared this helpful
info with us. Please keep us informed. Thanks for
sharing.
I think your idea will be very helpful for me.
I will inform you if its work for me as well. Thank you for sharing this amazing articles.
thanks a lot.
I’ve been browsing online more than three hours
today, yet I never found any interesting article like yours.
It is pretty worth enough for me. In my opinion,
if all web owners and bloggers made good content as you
did, the internet will be much more useful than ever before.
neugierig, und das Analogon ist?
[url=http://999tovarov.tumblr.com/]porkkl[/url]
And also Wikipedia: Guidebookk of Style, which uses a style overview–
as a whole editors tend to obtain understanding off suitable
composing styles as well as in-depth format with time.
Nice answers in return of this issue with firm arguments and describing the whole thing about that.
You can certainly see your expertise in the work you
write. The arena hopes for more passionate writers such as you who are not afraid to say how they
believe. All the time follow your heart.
I have been reading out many of your posts and it’s nice stuff. I will make sure to bookmark your website.
[url=http://choisetop.tumblr.com/]jaymeskl[/url]
Thanks for finally writing about >Obstrucción Aérea Recurrente – Eqcovet <Loved it!
I woluld like to use the opportunity of thanking you for thast professional guidance
I have usualoly enjoyed visiting your site. I’m looking
forward to tthe commencedment of my university research and the entire
prep would never have been complete without dropping by this site.
If I may be of any assistance to others, I would
be happy too help by means of whatt I have learned fro here.
Completely I share your opinion. Thought good, it agree with you.
[url=https://twitter.com/Shop_so_easy]porkkl[/url]
There are many symptoms of diabetes but we will focus here on most common symptoms of Diabetes.Here is list of these symptoms.
Hello, I read your blogs like every week. Your writing style is awesome, keep doing what you’re doing!
I go to see daily some blogs and blogs to read articles or reviews, but this
weblog presents quality based writing.
Ich denke, dass Sie den Fehler zulassen. Geben Sie wir werden besprechen. Schreiben Sie mir in PM.
[url=http://kendalbmx.co.uk/forum/index.php?topic=10491.new#new]saturnkl[/url]
Howdy! I realize this is somewhat off-topic however I
needed to ask. Does operating a well-established blog like yours take a large amount of work?
I am completely new to operating a blog but
I do write in my journal every day. I’d like to start a blog so I can share my experience and views online.
Please let me know if you have any suggestions or tips for brand new aspiring blog owners.
Appreciate it!
DR
Our publishing partner, Globe Scientific Posting Co. (WSPC), is very
dedicated to making the brand-new INNOVATION journal attain, a high influence aspect
as soon as possible, an initiative which boith people and our coworkers on the Conjtent Booard ihtend to support completely.
http://www.engagethru.com/vpxl-without-prescription-idaho.html
http://1785c.com/home.php?mod=space&uid=72051&do=profile
LU
http://clinicalnlptool.com/docs/index.php/Garotinho_Comendo_Grinalda_Vizinha_Redtube_Vern%C3%A1culo
Hello, i read your blog from time to time
and i own a similar one and i was just curious if you get
a lot of spam feedback? If so how do you stop it, any plugin or anything you can advise?
I get so much lately it’s driving me mad so any help is very much appreciated.
http://savadom.com/?option=com_k2&view=itemlist&task=user&id=33469
I used to be suggested this website by my cousin. I am not positive
whether or not this publish is written through him as no one else understand such specific approximately my problem.
You are amazing! Thanks!
While in the age of task sharing, ride-sharing, apartment
sharing and even dinner party sharing, it was merely a matter of period before house – cleaning services registered in around the fun.
É essencial explicar ԛue ɑ menopausa nãо é uma doença е, sim, uma consequência dа vida adulta ⅾa senhora.
http://bucetagostosaxxx.com.br
At this time it looks like BlogEngine is the best blogging platform available right now.
(from what I’ve read) Is that what you are using on your blog?
With up to 96TB of super-quick storage enabling publishers to work on 18 avenues of 4K and including 512GB of Memory and multiple
PC’s with 20 Cores of handling strength, the organic rate
of the Online 2000 will cut through your most challenging imaginative responsibilities.
moi connaГ®t, comment il faut entrer…
[url=http://songrovac0i.tumblr.com/]ekl[/url]
Whether you are a regional business or an international,
we satisfy all type of business requirements.
You actually make it appear really easy together with your presentation however
I in finding this topic to be actually one thing which I feel I might never understand.
It sort of feels too complex and extremely
vast for me. I am taking a look forward on your subsequent
submit, I’ll try to get the grasp of it!
Neighborhood Seo getting in touch with runs in a similar way to various other working as
a consultants.
Remarkable things here. I am very glad to see your article.
Thanks so much and I am looking ahead to contact you.
Will you kindly drop me a mail?
We will organize every part from bank accounts to workplace
house to ensure that your American firm formation runs easily right from the beginning.
Credo che si sbaglia. Sono sicuro. Io propongo di discuterne.
[url=https://twitter.com/roberttierrez]sheffieldkl[/url]
This important expiration notification proposal notifies you in regards to the expiration discover of your domain registration for xxxxxxxxxxxxxxxxxxx
seo submission.
After we settle the terms of the job, we will send you the proof for you to
examine and give us the go. We then print the magazines, do the binding and finish,
pack them in safe boxes and ship them to your place in just a few days.
Learning SEO takes time, but any person can discover a few essential methods really rapidly.
Another tonneau cover Extang can be very happy with is their
Trifecta which is really a folding tonneau cover.
Desidero incoraggiarvi a visitare il sito, con un enorme numero di articoli sul tema che vi interessa. Possibile cercare un link.
[url=http://mishushinavoq.tumblr.com/]tajahkl[/url]
Hola! I’ve been following your weblog for a while now and finally got the courage to go ahead and give you
a shout out from Porter Tx! Just wanted to tell you keep up the good work!
Thank you for the good writeup. It in fact was a amusement account it.
Look advanced to far added agreeable from you! By the way, how could we
communicate?
Since the admin of this web page is working,
no hesitation very shortly it will be famous, due to its quality
contents.